Hvordan batterier virker og virker
 I den bredeste betydning af ordet inden for teknologi refererer udtrykket "batteri" til en enhed, der tillader under visse driftsforhold at akkumulere en bestemt type energi og i andre at bruge den til menneskelige behov.
I den bredeste betydning af ordet inden for teknologi refererer udtrykket "batteri" til en enhed, der tillader under visse driftsforhold at akkumulere en bestemt type energi og i andre at bruge den til menneskelige behov.
De bruges, hvor det er nødvendigt at indsamle energi i en vis tid og derefter bruge den til at udføre store arbejdskrævende processer. For eksempel tillader hydrauliske akkumulatorer, der bruges i sluser, skibe at stige til et nyt niveau på flodlejet.
Elektriske batterier arbejder med elektricitet efter samme princip: Først akkumulerer (akkumulerer) elektricitet fra en ekstern ladekilde og giver den derefter til tilsluttede forbrugere til at udføre arbejde. Af deres natur tilhører de kemiske strømkilder, der er i stand til at udføre periodiske cyklusser med afladning og opladning gentagne gange.
Under drift sker der konstant kemiske reaktioner mellem komponenterne i elektrodepladerne med deres fyldstof - elektrolyt.
Et skematisk diagram af en batterienhed kan repræsenteres af en forenklet tegning, når to plader af forskellige metaller med ledninger indsættes i karrets krop for at give elektriske kontakter. En elektrolyt hældes mellem pladerne.
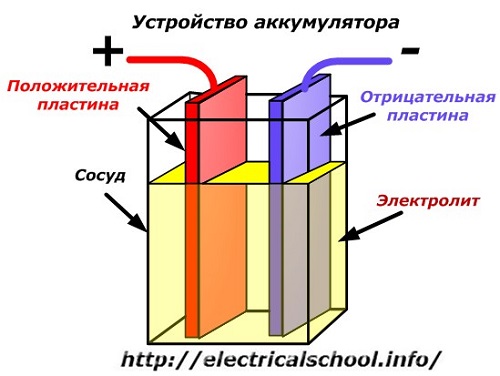
Batteridrift, når det er afladet
Når en belastning, såsom en pære, forbindes til elektroderne, skabes et lukket elektrisk kredsløb, hvorigennem afladningsstrømmen løber. Det dannes ved bevægelse af elektroner i metaldele og anioner med kationer i elektrolytten.
Denne proces er konventionelt vist på et diagram med et nikkel-cadmium elektrodedesign.
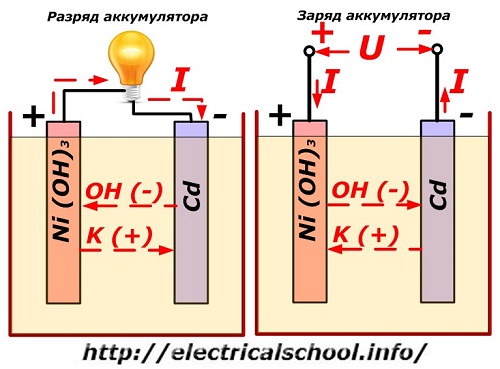
Her bruges nikkeloxider med grafittilsætningsstoffer, som øger den elektriske ledningsevne, som den positive elektrodes materiale. Metallet i den negative elektrode er svampet cadmium.
Under udledning frigives aktive iltpartikler fra nikkeloxider til elektrolytten og ledes til de negative plader, hvor cadmiumet oxideres.
Batteriydelse under opladning
Når belastningen er slået fra, påføres en konstant (i visse situationer pulserende) spænding til pladeterminalerne af en større værdi end for et opladet batteri med samme polaritet, når plus- og minusterminalerne på kilden og forbrugeren falder sammen .
Opladeren har altid mere strøm, hvilket "undertrykker" restenergien i batteriet og skaber en elektrisk strøm i modsat afladningsretning. Som følge heraf ændres de interne kemiske processer mellem elektroderne og elektrolytten. For eksempel, på en kasse med nikkel-cadmium-plader, er den positive elektrode beriget med oxygen, og den negative - til en tilstand af ren cadmium.
Når batteriet er afladet og opladet, ændres den kemiske sammensætning af materialet i pladerne (elektroderne), men elektrolytten ændres ikke.
Metoder til batteritilslutning
Parallel forbindelse
Mængden af afladningsstrøm en person kan modstå afhænger af mange faktorer, men primært designet, anvendte materialer og deres dimensioner. Jo større areal af pladerne ved elektroderne er, jo større strøm kan de modstå.
Dette princip bruges til at forbinde celler af samme type parallelt i batterier, når det er nødvendigt at øge strømmen til belastningen.Men for at oplade et sådant design vil det være nødvendigt at øge kildens effekt. Denne metode bruges sjældent til færdige strukturer, da det nu er meget lettere at købe det nødvendige batteri med det samme. Men producenter af syrebatterier bruger det og forbinder forskellige plader i enkelte blokke.
Seriel forbindelse
Afhængigt af de anvendte materialer kan der genereres en spænding på 1,2 / 1,5 eller 2,0 volt mellem de to elektrodeplader på batterier, der er almindelige i hverdagen. (Faktisk er dette område meget bredere.) Det er klart, at det ikke er tilstrækkeligt til mange elektriske enheder. Derfor seriekobles batterier af samme type, og det sker ofte i ét tilfælde.
Et eksempel på et sådant design er den udbredte biludvikling baseret på svovlsyre og blyelektrodeplader.
Normalt blandt mennesker, især blandt transportchauffører, er det sædvanligt at kalde enhver enhed for et batteri, uanset antallet af dets bestanddele - kasser. Dette er dog ikke helt korrekt.Strukturen, samlet af flere kasser forbundet i serie, er allerede et batteri, for hvilket det forkortede navn «АКБ» er påført... Dens interne struktur er vist på figuren.
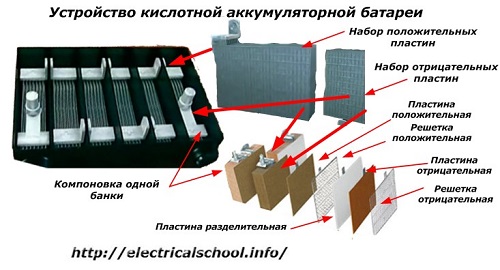
Hver af glassene består af to blokke med et sæt plader til de positive og negative elektroder. Blokkene passer ind i hinanden uden metalkontakt med mulighed for en pålidelig galvanisk forbindelse gennem elektrolytten.
I dette tilfælde har kontaktpladerne et ekstra gitter og er adskilt fra hinanden af en skilleplade.
Forbindelse af pladerne i blokke øger deres arbejdsområde, reducerer den samlede modstand af hele strukturen og giver dig mulighed for at øge kraften i den tilsluttede belastning.
På ydersiden af kassen har et sådant batteri de elementer, der er vist på nedenstående figur.
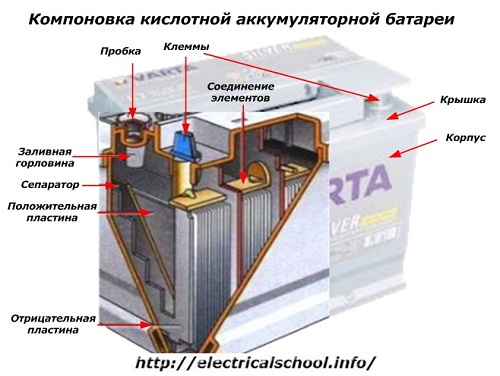
Det viser, at det robuste plastikhus er forseglet med et dæksel og udstyret med to terminaler (normalt kegleformede) på toppen for tilslutning til bilens elektriske kredsløb. Polaritetsmærker er stemplet på deres terminaler: «+» og «-«. Normalt har den positive terminal en lidt større diameter end den negative terminal for at blokere ledningsfejl.
Batterier, der kan serviceres, har et påfyldningshul på toppen af hver krukke for at kontrollere elektrolytniveauet eller tilsætte destilleret vand under drift. Der er skruet en prop ind i den, som beskytter kabinettets indvendige hulrum mod forurening og samtidig forhindrer elektrolytten i at spilde, når batteriet vippes.
Da der med en kraftig ladning er gasning fra elektrolytten mulig (og denne proces er mulig under intensiv kørsel), laves huller i propperne for at forhindre, at trykket inde i kassen stiger.Ilt og brint samt elektrolytdampe kommer ud gennem dem. Det anbefales at undgå sådanne situationer, der involverer for høje ladestrømme.
Samme figur viser elementernes forbindelse mellem bankerne og arrangementet af elektrodepladerne.
Bilstarterbatterier (blysyre) fungerer efter princippet om dobbeltsulfatering. Under afladning / opladning finder en elektrokemisk proces sted på dem, ledsaget af en ændring i den kemiske sammensætning af elektrodernes aktive masse med frigivelse / absorption af vand i elektrolytten (svovlsyre).
Dette forklarer stigningen i elektrolyttens vægtfylde under opladning og faldet, når batteriet er afladet. Med andre ord giver tæthedsværdien dig mulighed for at vurdere batteriets elektriske tilstand. En speciel enhed bruges til at måle det - et bilhydrometer.
Destilleret vand, som er en del af elektrolytten i syrebatterier, bliver til en fast tilstand - is ved negative temperaturer.For at forhindre bilbatterier i at fryse i koldt vejr er det derfor nødvendigt at anvende særlige foranstaltninger, der er fastsat i reglerne til udnyttelse.
Hvilke typer batterier findes der?
Moderne produktion til forskellige formål producerer mere end tre dusin produkter med forskellig sammensætning af elektroder og elektrolyt. 12 kendte modeller kører kun på lithium.

Følgende kan findes som elektrodemetal:
-
at føre;
-
jern;
-
lithium;
-
titanium;
-
kobolt;
-
cadmium;
-
nikkel;
-
zink;
-
sølv;
-
vanadium;
-
aluminium
-
nogle andre ting.
De påvirker de elektriske udgangskarakteristika og dermed applikationen.
Evnen til at modstå kortvarige høje belastninger som følge af rotation af krumtapaksler af forbrændingsmotorer af elektriske startmotorer er karakteristisk for bly-syre-batterier. De er meget udbredt inden for transport, uafbrydelige strømforsyninger og nødstrømssystemer.
Standard galvaniske celler (almindelige batterier) erstattes normalt af nikkel-cadmium-, nikkel-zink- og nikkel-metalhydrid-batterier.
Men lithium-ion- eller lithium-polymer-design fungerer pålideligt i mobile og computerenheder, byggeværktøjer og endda elektriske køretøjer.
Afhængigt af den anvendte elektrolyttype er batterierne:
-
sur
-
basisk.
Der er en klassificering af batterier efter formål. For eksempel er der under moderne forhold dukket enheder op, der bruges til energioverførsel - genopladning af andre kilder. Det såkaldte eksterne batteri hjælper ejerne af mange mobile enheder i mangel af et vekslende elektrisk netværk. Den er i stand til gentagne gange at oplade en tablet, smartphone, mobiltelefon.
Alle disse batterier har samme funktionsprincip og en lignende enhed. For eksempel gentager lithium-ion fingermodellen vist i figuren nedenfor på mange måder designet af de syrebatterier, der blev diskuteret tidligere.
Her ser vi de samme kontaktelektroder, plader, separator og hus. Kun de er lavet under hensyntagen til andre arbejdsforhold.
Grundlæggende elektriske egenskaber for et batteri
Enhedens drift påvirkes af parametrene:
-
kapacitet;
-
energitæthed;
-
selvudladning;
-
temperatur regime.
Kapaciteten kaldes batteriets maksimale ladning, som det er i stand til at give under afladningen til den laveste spænding. Det udtrykkes i vedhæng (SI-system) og amperetimer (ikke-systemenhed).
Som kapacitetstype er der «energikapacitet», som bestemmer den energi, der frigives under afladningen til den mindst tilladte spænding. Det måles i joule (SI) og watt-timer (ikke-SI-enheder).
Energitæthed udtrykt som forholdet mellem mængden af energi og batteriets vægt eller volumen.
Selvafladning overvej tabet af kapacitet efter opladning i fravær af en belastning på terminalerne. Dette afhænger af designet og forværres af isolationsbrud mellem elektroderne af mange årsager.
Driftstemperaturen påvirker de elektriske egenskaber, og i tilfælde af alvorlige afvigelser fra normen specificeret af producenten, kan det beskadige batteriet. Varme og kulde er uacceptable, de påvirker forløbet af kemiske reaktioner og trykket fra miljøet inde i kassen.
