Polære og ikke-polære dielektrika
Ifølge den klassiske fysiks synspunkter er dielektrika fundamentalt forskellige fra ledere, fordi der under normale forhold ikke er frie elektriske ladninger i dem. Den samlede ladning af de partikler, der danner dielektriske molekyler, er nul. Dette betyder dog slet ikke, at disse stoffers molekyler ikke er i stand til at udvise elektriske egenskaber.
Alle kendte lineære dielektrika kan opdeles i to store grupper: polære dielektrika og ikke-polære dielektrika. Denne opdeling er indført på grund af forskellene i polarisationsmekanismerne for molekylerne i hver type dielektrikum. Faktisk viser polarisationsmekanismen sig at være et ekstremt vigtigt aspekt i studiet af både de fysiske og kemiske egenskaber af dielektrika og i studiet af deres elektriske egenskaber.
Ikke-polære dielektriske stoffer
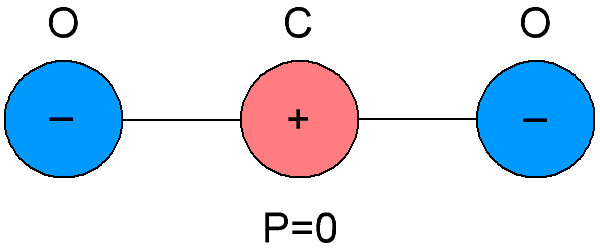
Ikke-polære dielektrika kaldes også neutrale dielektrika, fordi molekylerne, som disse dielektrika er sammensat af, er forskellige i sammenfaldet af tyngdepunkterne for de negative og positive ladninger inde i dem.Som et resultat viser det sig, at molekylerne af ikke-polære dielektriske stoffer ikke har deres eget elektriske moment, det er lig med nul. Og i mangel af et eksternt elektrisk felt er de positive og negative ladninger af molekylerne af sådanne stoffer arrangeret symmetrisk.
Hvis et eksternt elektrisk felt påføres et ikke-polært dielektrikum, så vil den positive og negative ladning i molekylerne blive forskudt fra deres oprindelige ligevægtsposition, molekylerne bliver til dipoler, hvis elektriske momenter nu vil være proportionale med styrken af det elektriske felt anvendt på dem, og vil blive rettet parallelt med feltet.
Eksempler på ikke-polære dielektriske stoffer, der med succes anvendes i dag som elektriske isoleringsmaterialer, er følgende: polyethylen, polystyren, kulbrinter, jordolieisoleringsolier osv. Også lyse repræsentanter for ikke-polære molekyler er for eksempel nitrogen, kuldioxid, metan osv. Hr.
Ikke-polære dielektrika er på grund af deres lave tangensværdier for dielektriske tab i vid udstrækning brugt som højfrekvente dielektrika i kondensatorer såsom K78-2.
Polær dielektrik
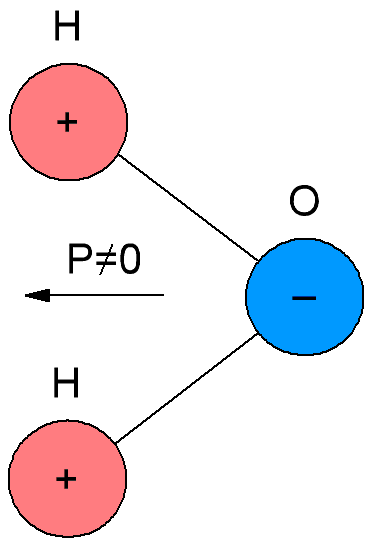
I polære dielektrika, som også kaldes dipoldielektrika, har molekylerne deres eget elektriske moment, det vil sige, at deres molekyler er polære. Årsagen er, at molekylerne af polære dielektrika har en asymmetrisk struktur, så massecentrene for negative og positive ladninger i molekylerne af sådanne dielektrika falder ikke sammen.
Hvis i en ikke-polær polymer nogle af brintatomerne er erstattet af atomer af andre grundstoffer eller af ikke-kulbrinteradikaler, så får vi kun et polært (dipol) dielektrikum, da symmetrien vil blive brudt som følge af en sådan udskiftning. Ved at bestemme polariteten af et stof ved dets kemiske formel skal forskeren selvfølgelig have en idé om den rumlige struktur af dets molekyler.
Når der ikke er noget eksternt elektrisk felt, er akserne af de molekylære dipoler orienteret vilkårligt på grund af termisk bevægelse, således at på overfladen af dielektrikumet og i hvert element af dets volumen er den elektriske ladning i gennemsnit nul. Men når et dielektrikum indføres i et eksternt felt, opstår der en delvis orientering af molekylære dipoler. Som et resultat opstår ukompenserede makroskopisk forbundne ladninger på overfladen af dielektrikumet, hvilket skaber et felt rettet mod det eksterne felt.
Eksempler på polære dielektrika omfatter følgende: chlorerede kulbrinter, epoxy- og phenolformaldehydharpikser, siliciumsiliciumforbindelser osv. Vand- og alkoholmolekyler er for eksempel også bemærkelsesværdige eksempler på polære molekyler. Polær dielektrik er meget udbredt inden for forskellige teknologiområder, såsom piezoelektrisk og ferroelektrisk, optik, ikke-lineær optik, elektronik, akustik osv.

