Elektrisk strøm i elektrolytter
Elektrisk strøm i elektrolytter er altid relateret til overførsel af stof. I metaller og halvledere overføres f.eks. stof ikke, når strøm passerer gennem dem, fordi elektroner og huller i disse medier er strømbærere, men i elektrolytter overføres de. Det skyldes, at stoffets positivt og negativt ladede ioner i elektrolytter fungerer som bærere af frie ladninger, slet ikke elektroner eller huller.
Smeltede forbindelser af mange metaller, såvel som nogle faste stoffer, hører til elektrolytter. Men de vigtigste repræsentanter for denne type ledere, som er meget udbredt i teknologi, er vandige opløsninger af uorganiske syrer, baser og salte.
Stoffet, når en elektrisk strøm passerer gennem elektrolytmediet, frigives på elektroderne. Dette fænomen kaldes elektrolyse… Når en elektrisk strøm passerer gennem elektrolytten, bevæger stoffets positivt og negativt ladede ioner sig samtidigt i modsatte retninger.
Negativt ladede ioner (anioner) skynder sig til den positive elektrode af strømkilden (anode), og positivt ladede ioner (kationer) til dens negative pol (katode).
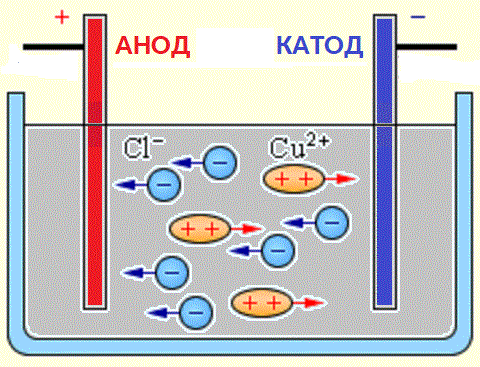
Kilder til ioner i vandige opløsninger af syrer, baser og salte er neutrale molekyler, hvoraf nogle splittes under påvirkning af en påført elektrisk kraft. Dette fænomen med at spalte neutrale molekyler kaldes elektrolytisk dissociation. For eksempel nedbrydes kobberchlorid CuCl2 ved dissociation i vandig opløsning til chloridioner (negativt ladet) og kobber (positivt ladet).
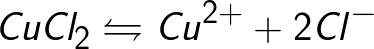
Når elektroderne er forbundet til en strømkilde, begynder det elektriske felt at virke på ioner i en opløsning eller smelte, da chloranioner bevæger sig til anoden (positiv elektrode) og kobberkationer til katoden (negativ elektrode).
Når de når den negative elektrode, neutraliseres de positivt ladede kobberioner af de overskydende elektroner ved katoden og bliver til neutrale atomer, der aflejres på katoden. Når de når den positive elektrode, donerer de negativt ladede klorioner en elektron hver under interaktionen med den positive ladning på anoden. I dette tilfælde kombineres de dannede neutrale kloratomer i par og danner Cl2-molekyler, og klor frigives i form af gasbobler ved anoden.
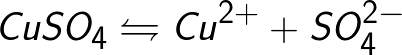
Ofte er elektrolyseprocessen ledsaget af interaktionen af dissociationsprodukter (dette kaldes sekundære reaktioner), når nedbrydningsprodukterne, der frigives på elektroderne, interagerer med opløsningsmidlet eller direkte med elektrodematerialet. Tag for eksempel elektrolysen af en vandig opløsning af kobbersulfat (kobbersulfat - CuSO4).I dette eksempel vil elektroderne være lavet af kobber.
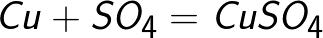
Kobbersulfatmolekylet dissocierer og danner en positivt ladet kobberion Cu+ og en negativt ladet sulfation SO4-. Neutrale kobberatomer aflejres som en fast aflejring på katoden. På denne måde opnås kemisk rent kobber.
Sulfat-ionen donerer to elektroner til den positive elektrode og bliver til den neutrale radikal SO4, som straks reagerer med kobberanoden (sekundær anodereaktion). Reaktionsproduktet ved anoden er kobbersulfat, som går i opløsning.
Det viser sig, at når en elektrisk strøm passerer gennem en vandig opløsning af kobbersulfat, opløses kobberanoden simpelthen gradvist, og kobber udfældes på katoden.I dette tilfælde ændres koncentrationen af den vandige opløsning af kobbersulfat ikke.
I 1833 etablerede den engelske fysiker Michael Faraday i løbet af eksperimentelt arbejde loven om elektrolyse, som nu er opkaldt efter ham.
Faradays lov giver dig mulighed for at bestemme mængden af primære produkter, der frigives på elektroderne under elektrolyse. Loven siger følgende: "Massen m af stoffet, der frigives på elektroden under elektrolyse, er direkte proportional med ladningen Q, der er gået gennem elektrolytten."
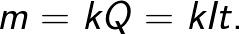
Proportionalitetsfaktoren k i denne formel kaldes den elektrokemiske ækvivalent.
Massen af stoffet, der frigives på elektroden under elektrolyse, er lig med den samlede masse af alle ioner, der kom til denne elektrode:
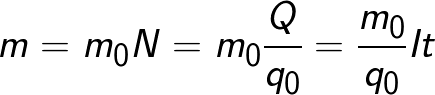
Formlen indeholder ladningen q0 og massen m0 af en ion, samt ladningen Q, der passerede gennem elektrolytten.N er antallet af ioner, der ankom til elektroden, når ladningen Q passerede gennem elektrolytten.Derfor kaldes forholdet mellem massen af ionen m0 og dens ladning q0 den elektrokemiske ækvivalent af k.
Da ladningen af en ion er numerisk lig med produktet af stoffets valens og den elementære ladning, kan den kemiske ækvivalent repræsenteres i følgende form:
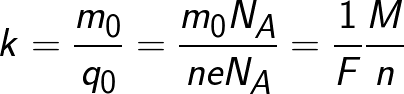
Hvor: Na er Avogadros konstant, M er stoffets molære masse, F er Faradays konstant.
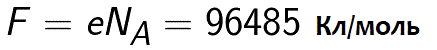
Faktisk kan Faraday-konstanten defineres som mængden af ladning, der skal passere gennem elektrolytten for at frigive et mol monovalent stof på elektroden. Faradays lov om elektrolyse tager derefter formen:
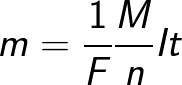
Fænomenet elektrolyse er meget udbredt i moderne produktion. For eksempel fremstilles aluminium, kobber, brint, mangandioxid og hydrogenperoxid industrielt ved elektrolyse. Mange metaller udvindes fra malme og behandles ved elektrolyse (elektroraffinering og elektroekstraktion).
Også takket være elektrolyse, kemiske strømkilder… Elektrolyse bruges til spildevandsrensning (elektroekstraktion, elektrokoagulering, elektroflotation). Mange stoffer (metaller, brint, klor osv.) opnås ved elektrolyse til galvanisering og galvanisering.
Se også:Fremstilling af brint ved elektrolyse af vand — teknologi og udstyr

