Elektroner opfører sig som bølger
Fysikere har længe vidst, at lys er en elektromagnetisk bølge. Den dag i dag er der ingen, der tvivler på denne position, da lys tydeligt demonstrerer alle tegn på bølgeadfærd: lysbølger kan overlappe hinanden, generere et interferensmønster, de er også i stand til at adskille, bøje rundt om forhindringer langs diffraktionstiden.
Når vi ser en fugl, der går som en and, svømmer som en and og kvaksalver som en and, kalder vi den fugl for en and. Så lyset er elektromagnetisk bølgebaseret på objektivt observerede tegn på en sådan bølges opførsel i lys.

Men i slutningen af det 19. og 20. århundrede skulle fysikere begynde at tale om lysets «partikel-bølge-dualisme». Det viser sig, at viden om, at lys er en elektromagnetisk bølge, ikke er alt, hvad videnskaben ved om lys. Forskere har opdaget en meget interessant funktion i lys.
Det viser sig, at lys på en eller anden måde manifesterer sig SOM opførsel af en strøm af partikler på en eller anden måde.Det viste sig, at den energi, som lyset bærer, efter at være blevet talt over et vist tidsrum af en speciel detektor, alligevel viser sig at være sammensat af individuelle (hele) stykker.
Derfor blev det rigtigt, at lysets energi er diskret, fordi den så at sige er sammensat af individuelle partikler - "kvanter", altså af de mindste hele portioner af energi. En sådan lyspartikel, der bærer en enhed (eller kvante) af energi, kom til at blive kaldt en foton.
Energien af en foton findes ved følgende formel:
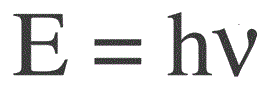
E — fotonenergi, h — Plancks konstant, v — frekvens.
Den tyske fysiker Max Planck etablerede først eksperimentelt kendsgerningen om lysbølgens diskrethed og beregnede værdien af konstanten h, som vises i formlen til at finde energien af individuelle fotoner. Denne værdi viste sig at være: 6.626 * 10-34 J * s. Planck offentliggjorde resultaterne af sit arbejde i slutningen af 1900-tallet.

Overvej for eksempel en lilla stråle. Frekvensen af sådant lys (f eller v) er 7,5 * 1014 Hz Plancks konstant (h) er 6,626 * 10-34 J * s. Det betyder, at energien af fotonen, (E), karakteristisk for farven violet, er 5 * 10-19 J. Dette er så lille en del af energien, at den er meget svær at fange.
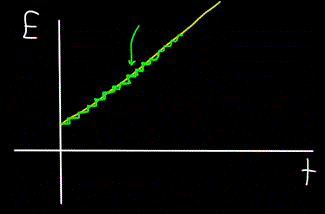
Forestil dig en bjergstrøm - den flyder som én enhed, og det er umuligt at se med det blotte øje, at åen faktisk består af individuelle vandmolekyler. I dag ved vi dog, at det makroskopiske objekt – flow – faktisk er diskret, det vil sige, at det består af individuelle molekyler.
Det betyder, at hvis vi kan placere en molekyletæller ved siden af strømmen for at tælle de vandmolekyler, der passerer, mens strømmen løber, vil detektoren altid kun tælle hele antal vandmolekyler, ikke delvise.
På samme måde vil grafen for fotonen E's samlede energi, beregnet på tidspunktet t — altid vise sig ikke at være lineær (gul figur), men trinvis (grøn figur):
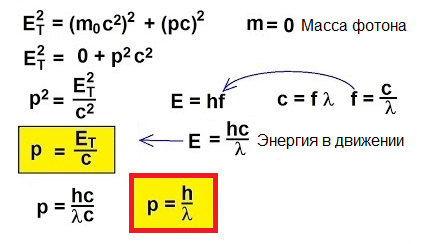
Så fotoner bevæger sig, de bærer energi, derfor har de momentum. Men en foton har ingen masse. Hvordan kan du så finde fremdrift?
Faktisk er den klassiske formel p = mv simpelthen uanvendelig for objekter, der bevæger sig med hastigheder tæt på lysets hastighed. For at forstå, hvordan man finder momentum i dette usædvanlige tilfælde, lad os vende os til speciel relativitet:
I 1905 forklarede Albert Einstein fra dette synspunkt fotoelektrisk effekt… Vi ved, at metalpladen har elektroner i sig, som inde i den tiltrækkes af atomernes positivt ladede kerner og derfor tilbageholdes i metallet. Men hvis man lyser sådan en plade med lys af en BESTEM frekvens, så kan man slå elektroner ud af pladen.
Det er, som om lys opfører sig som en strøm af partikler med momentum.Og selvom en foton ikke har nogen masse, interagerer den stadig på en eller anden måde med en elektron i et metal, og under visse forhold er en foton i stand til at slå en elektron ud.
Så hvis en foton, der falder ind på pladen, har nok energi, vil elektronen blive slået ud af metallet og bevæge sig ud af pladen med hastigheden v. Sådan en udslået elektron kaldes en fotoelektron.
Da den udslåede elektron har en kendt masse m, vil den have en vis kinetisk energi mv.
Fotonens energi, når den virkede på metallet, omdannes til energien fra elektronens udgang fra metallet (arbejdsfunktion) og til elektronens kinetiske energi, som den udslåede elektron begynder at bevæge sig i. ud af metallet og efterlader det.
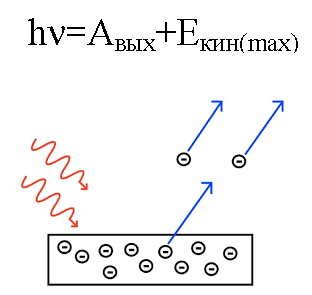
Antag, at en foton med kendt bølgelængde rammer overfladen af et metal, for hvilket arbejdsfunktionen (af en elektron fra metallet) er kendt. I dette tilfælde kan den kinetiske energi af en elektron, der udsendes fra et givet metal, let findes, såvel som dens hastighed.
Hvis fotonens energi ikke er tilstrækkelig til, at elektronen kan udføre arbejdsfunktionen, så kan elektronen simpelthen ikke forlade overfladen af det givne metal, og fotoelektronen dannes ikke.
I 1924, en fransk fysiker Louis de Broglie fremsat en banebrydende idé, hvorefter ikke kun fotoner af lys, men elektroner selv kan opføre sig som bølger. Videnskabsmanden udledte endda en formel for elektronens hypotetiske bølgelængde. Disse bølger blev efterfølgende kaldt "de Broglie-bølger".
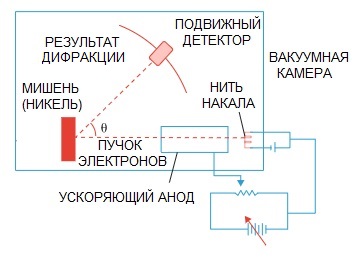
De Broglies hypotese blev senere bekræftet. Et fysikeksperiment om elektrondiffraktion, udført i 1927 af amerikanske videnskabsmænd Clinton Davison og Lester Germer, påpegede endelig elektronens bølgenatur.
Når en elektronstråle blev rettet gennem en speciel atomstruktur, ser det ud til, at detektoren skulle have registreret billedet som partikler, der flyver efter hinanden, hvilket logisk nok ville forventes, hvis elektroner var partikler.
Men i praksis har vi et billede, der er karakteristisk for bølgediffraktion. Desuden er længderne af disse bølger fuldstændig i overensstemmelse med konceptet foreslået af de Broglie.
I sidste ende gjorde de Broglies idé det muligt at forklare princippet i Bohrs atommodel, og senere gjorde det det muligt for Erwin Schrödinger at generalisere disse ideer og lægge grundlaget for moderne kvantefysik.
